
附件一: 一、组织机构: 主办单位:中国国际科技促进会 (主管单位:中国人民共和国科学技术部) 承办单位:北京产学研创科技有限公司 会议形式:专题解读、现场指导答疑、案例分析点评、解决难点问题。 二、 主要内容: 1、药品的CTD格式申报资料撰写要求(要点解读); 2、ICH原料药的申报要求(要点解读); 3、ICH制剂申报资料正文及撰写要求(要点解读); 4、药品进入国际市场的准则和要求;药品国际注册的路径; 5、ICH、FDA、EMA的CTD及eCTD相关技术指导原则; 6、药品国际注册项目管理; 7、药品国际注册过程与关键技术;具体实例解析; 8、药政事务部门职责; 9、ICH Q12药品生命周期管理技术与药政考量; 10、ICH-Q8(R2))制药开发; 11、ICH Q11 原料药开发和制造综述; 12、基于ICH-Q11的原料药申报实例; 三、师资介绍: 徐老师:国家食品药品监督管理局特聘讲师,商务部医药进出口技术服务中心专家。专业特长:质量风险、国际注册、药政法规、验证。 熊老师:(主任药师、教授 、博士研究生导师。)国家新药审评中心专家组成员、澳洲永久居民、澳洲悉尼大学药学院高级访问学者。专业特长:国际药品注册、中药药剂与分析。 四、 参会对象: 真诚欢迎,制药企业、医药研发、高等院校、科研院所等相关专业人员;药品生产企业的国际注册、药物研究、质量管理、法规事务、生产部门等有关人员。 五、 时间地点: 时 间:2017年9月22日-24日( 22日全天报到) 地 点:北京市(具体地点报名后另行通知) 六、参会费用: 2200元/人,(含会议费、中餐费、场地费、资料费等筹办费)。晚餐、住宿统一安排,费用自理。 七、咨询方式: 联系人:石艳军 手 机:13716523499 电 话:010-62886740 传 真:010-62887195 邮 箱:kecuhui@126.com 网 址:http://www.ciapst.org 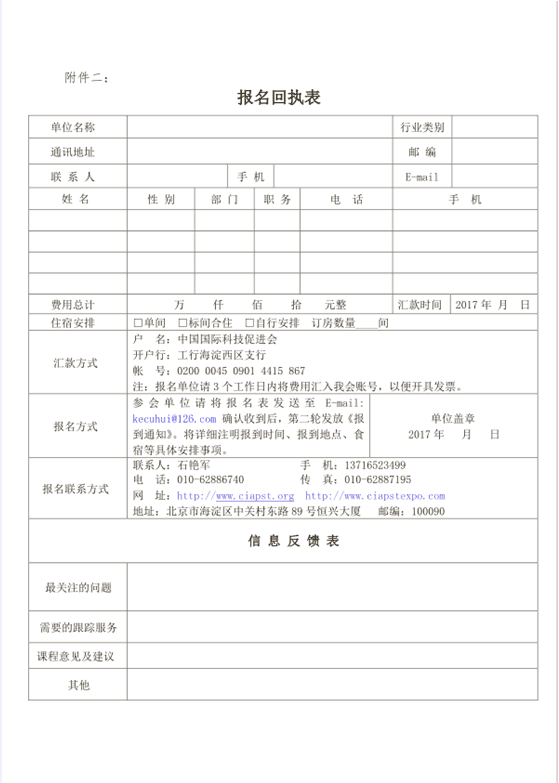
|